Elektrooxidation an kalt-niedergeschlagenen binären Metallschichten auf Glaskohlenstoff-Substraten
Jens Poppe,
Technische Universität Chemnitz, Institut für Chemie, AG Elektrochemie, Straße der Nationen 62, D-09111 Chemnitz
Zur Erhöhung der elektrokatalytischen Aktivität bei der Elektrooxidation kleiner organischer Moleküle wie Methanol, Ethanol und Ethylenglykol, z.B. in einer Brennstoffzellenanwendung, werden elektrokatalytisch wirksame Metalle auf unterschiedlichste Weise miteinander kombiniert. So versucht man z.B. im Sinne eines "bifunktionalen Mechanismus" [1], zwei Metalle mit unterschiedliche Adsorptionseigenschaften für organische und für Sauerstoff-haltige Spezies auf atomarer Ebene miteinander zu vermischen.
Elektrokatalytische Eigenschaften werden in zunehmendem Maß an nanogroßen Partikeln untersucht [2].
Modellvorstellung
Gewöhnlich wird die aktivierte Chemisorption einer oxidierbaren Spezies auf einer katalytisch wirksamen (Edelmetall-) Oberfläche als dominierender Faktor in der elektrokatalytischen Oxidation organischer Moleküle angenommen (Modell der aktivierten Adsorption).
Im bezug auf Gold erscheint dieser Ansatz unpassend, denn Gold ist trotz schlechter Adsorptionseigenschaften [1] ein hervorragender Elektrokatalysator in alkalischer Lösung.
Die große Aktivität wird einerseits mit einem Modell gedeutet, daß vom Vorhandensein einer reaktiven Spezies ausgeht, die durch Kopplung von oxidierbaren Spezies mit OH- schon in der Lösungsphase entsteht, und zwar vor dem eigentlichen Oxidationsprozeß. Ein weiteres Modell [3] - das sogenannte Incipient hydrous oxide/ adatom mediator (IHOAM) model (siehe Abb.1) - postuliert, daß eine kleine Anzahl "wäßriger Oxid"-Adatom-Spezies als Reaktionsvermittler wirkt.
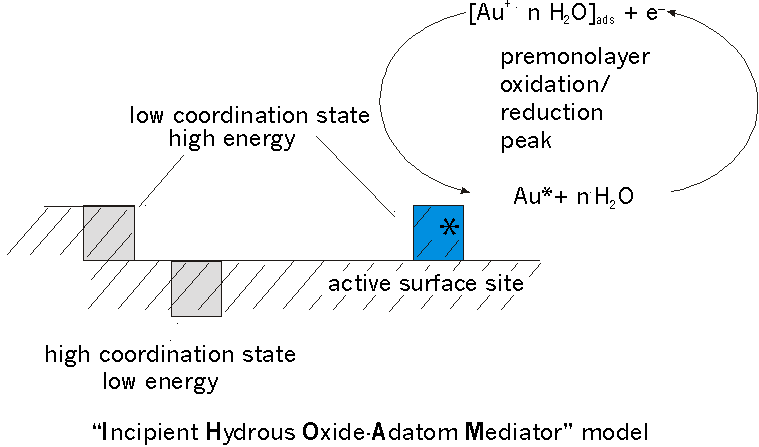
Nach diesem Modell unterliegen aktivierte bzw. niedrig koordinierte Oberflächen-Adatome einer "unomalen" Oxidation - sogenannte "premonolayer oxidation" - , die im Vergleich zu der normalen "monolayer oxidation" bei niedrigeren Potentialen vonstatten geht. Die dazu "befähigten" Atome (nur ca 0,1% der Oberflächenatome) sind diejenigen, die sich – aus dem Kristallverband herausgelöst – an exponierter "Adatom"-Position befinden. Es wird angenommen, daß ein Metall-Adatom einem zyklischen Redox-Übergang als Teil des elektrokatalytischen Prozesses unterliegt.
Präparation
Hier wurde der Ansatz gewählt, eine binäre Metallschicht mittels einer Hochvakuum-Verdampfungstechnik [4] auf ein Flüssigstickstoff-gekühltes Glaskohlenstoffsubstrat aufzubringen: Die "flash-verdampften" Metallpartikel (vgl. Abb.2, a ) verlieren ihre kinetische Energie beim Auftreffen auf die N2-kalte Substratoberfläche nahezu vollständig (c). Das Kristallwachstum bzw. die Bildung größerer Körner wird unterbunden, und die kalt-abgeschiedenen Metallkomponenten bilden eine homogene, dispergierte Schicht aus. Unter bestimmten Voraussetzungen entstehen Schichten, die auch bei Raumtemperatur amorph sind.

Durch die physikalische Vakuum-Deposition (PVD) von Metallpartikeln auf N2-gekühlten Substraten erhoffen wir uns eine Erhöhung der Zahl der exponierten – alleinstehenden – Atome, die die Elektrooxidation von MeOH, EtOH oder Ethylenglykol im Sinne des IHOAM-Modells fördern.
Darüber hinaus ermöglicht es diese Abscheidungsmethode, auch binäre Legierungssysteme zu erzeugen, die aufgrund einer thermodynamischen Mischungslücke metastabil sind.
Der Fall einer Mischungslücke tritt beim binären System Gold-Nickel auf, dessen Komponenten für sich allein in alkalischen Brennstoffzellen-Systemen zum Einsatz kommen.
Messungen
Die typischerweise 15nm dicken Schichten auf Glaskohlenstoffsubstraten werden hinsichtlich der Elektrooxidation von Methanol, Ethanol und Ethylenglykol in 0,1 M KOH mittels zyklischer Voltammetrie und spektroelektrochemischer Methoden untersucht.
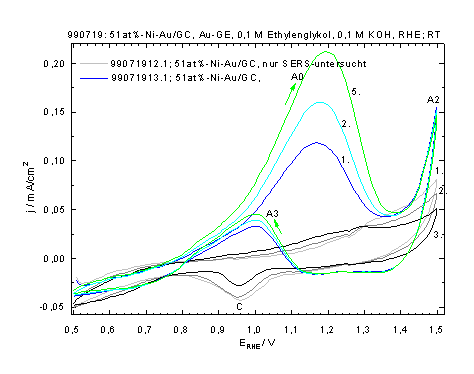
In der Abb.3 ist eine zyklovoltammetrische Messung einer Schicht aus Gold und Nickel auf Glaskohlenstoff wiedergegeben. Interessanterweise baut sich die Ethylenglykol-Elektrooxidation erst erst im Laufe einiger Zyklen auf.
[1] M. Watanabe, S. Motoo, Enhancement of the oxidation of methanol on platinum and palla-dium by gold ad-atoms, Electroanal. Chem and Interfacial Electrochem., 60 (1975) 259-266
[2] N. Tateishi..Y.Takasu, , J. Electroanal. Chem., 352 (1993) 243-252
[3] L.D. Burke, G.M. Bruton, J.A. Collins, Electrochim. Acta 44 (1998) 1467-1479
[4] http://www.tu-chemnitz.de/physik/PHDS/
26.10.99
